

微波消解中常用酸通常分為兩類:
非氧化性酸,如鹽酸,氫氟酸,磷酸,稀硫酸和稀高氯酸;
氧化性酸,如硝酸,熱濃高氯酸,濃硫酸和過氧化氫。
1、硝酸
硝酸有以下特性:
65%濃度沸點為120°C;
濃度小于2M 時,氧化能力較弱;隨著濃度和反應溫度的增加,氧化能力增強;
氧化有機物的典型酸,反應式如下: (CH2)X + 2HNO3 -> CO2(g) + 2NO + 2H2O;
溶解大多數金屬硝酸鹽, Au 和Pt 例外(不能氧化) , Al, B, Cr, Ti 和Zr 例外(鈍化);
這些金屬要求混酸或稀硝酸;
經常與H2O2, HCl和H2SO4混用;
高純度經常用于痕量分析。
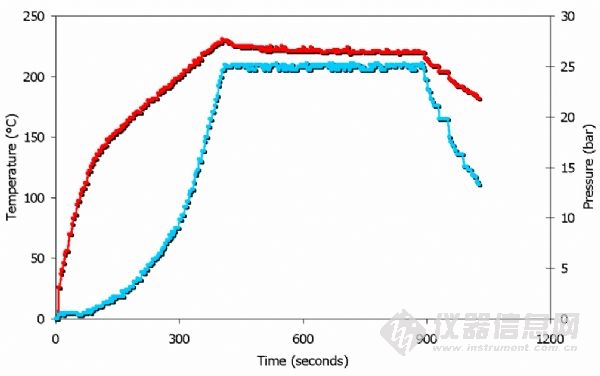
以上為微波加熱過程中硝酸的溫度壓力曲線。
注意:壓力為25bar 時,溫度為225°C。
過氧化氫
過氧化氫是氧化劑(2H2O2 -> 2H2O + O2); 與硝酸混合可減少含氮蒸汽,通過增加溫度加速有機樣品的
消解過程.
典型混合比例是HNO3:H2O2= 4:1 (體積/體積)。
鹽酸
鹽酸有以下特性:
與20,4% H2O混合后恒沸點為110°C;
38% 濃度;
溶解弱酸鹽(碳酸鹽,磷酸鹽)及大多數金屬,AgCl, HgCl 和TiCl 例外;
過量HCl可提高AgCl的溶解能力,使之轉換為AgCl2-;
強配位能力;
由于溶液中可成為氯化物的特性而廣泛用于鐵基合金;
其他可用于Ag (I), Au (II), Hg (II), Ga (III), Tl (III), Sn (IV), Fe (II) and Fe (III);
不溶解Al, Be, Cr, Ti, Zr, Sn和Sb的氧化物;Ba和Pb的硫酸鹽,II價氟化物, SiO2, TiO2和ZrO2。

以上為微波加熱過程中鹽酸的溫度壓力曲線。
注意:壓力為25bar 時,溫度為205°C。
氫氟酸
氫氟酸有以下特性:
酸消解
40%濃度時沸點為108°C;
非氧化性,強配位能力;
用于消解礦物,礦石,土壤,巖石甚至含硅蔬菜;
按以下反應,主要用于消解硅: SiO2 + 6HF -> H2SiF6 + 2H2O;
經常與HNO3 或 HClO4混用。
蒸發/濃縮
樣品溶解后,為避免損壞儀器或重新溶解不溶氟化物,很多分析要求去除HF;
很多分析如As, B, Se, Sb, Hg 和Cr 可能揮發。
配位
可通過加入硼酸去除溶液中的HF;
發生以下反應: H3BO3 + 3HF -> HBF3(OH) + 2H2O and HBF3(OH) + HF -> HBF3 + H2O;
10-50 倍過量硼酸加快反應速率。
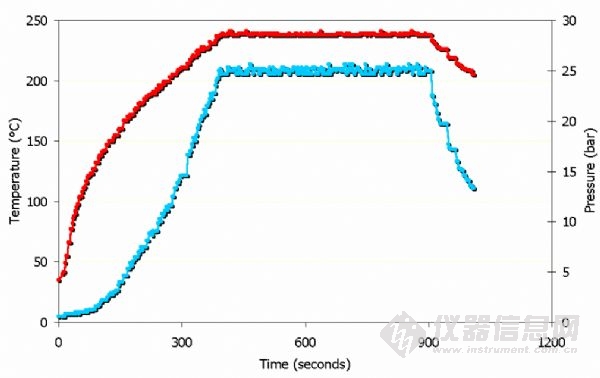
以上為微波加熱過程中氫氟酸的溫度壓力曲線。
注意:壓力為25bar 時,溫度為240°C.
硫酸
硫酸有以下特性:
98%濃度的硫酸沸點為340°C,高于TFM 罐子的最大工作溫度;
為避免罐子損壞應仔細關注反應;
通過脫水反應破壞有機物;
很多硫酸鹽是不可溶的(Ba, Sr, Pb)。
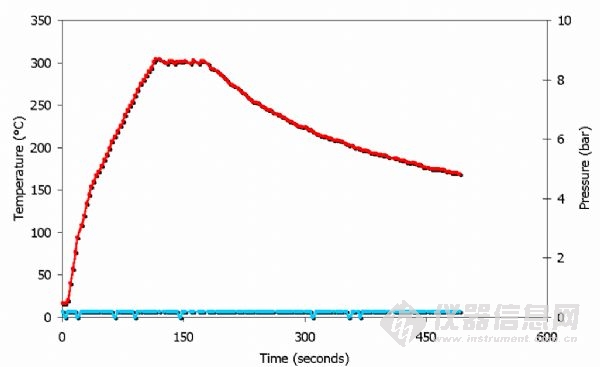
以上為微波加熱過程中硫酸的溫度壓力曲線。
注意溫度被控制在300°C (僅1 分鐘),沒有任何壓力增加。很明顯,在MDR 轉子中使用濃硫酸是不適宜的.300°C 是TFM 罐子的臨界溫度,對PFA 罐子來說溫度過高(該溫度下將熔化)。所以,建議使用硫酸時應進行嚴格的溫度控制。
高氯酸
高氯酸以下特性:
72%濃度時沸點203°C;
熱且濃的高氯酸是強氧化性酸;
與有機物反應迅速,有時爆炸;
經常與硝酸混用用于有機物消解;
所有高氯酸鹽可溶,KClO4除外;
在密閉微波罐體中,高氯酸在245°C 分解,產生大量氣體副產品和大量壓力。
警告
當使用高氯酸時應特別注意.
不要完全使用高氯酸消解有機樣品.
當溫度不超過200°C 時可用高氯酸消解無機樣品,高氯酸體積應小于整個溶液體積的20%(體積/體積)。
王水
王水有以下特性:
鹽酸和硝酸以3:1 (體積/體積)混合;
產生NOCl(亞硝酰氯),加熱時分解成NO和Cl2;
溶解貴金屬;
必須現制并立即用完,否則將變成氯氣使罐體過壓。
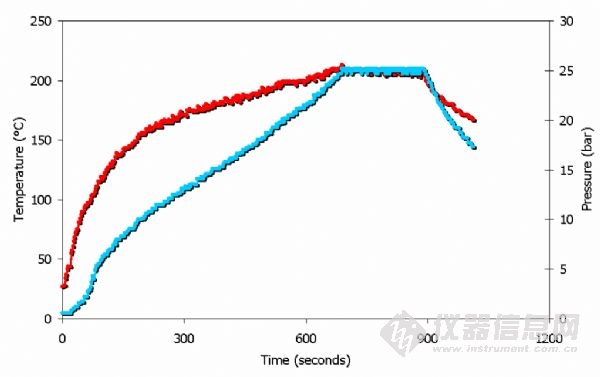
以上為微波加熱過程中王水的溫度壓力曲線。
注意:壓力為25bar 時,溫度為200°C。